Pengenalan Alat Dan Teknik Laboratorium Mikrobiologi – Sebelum masuk ke inti pembahasan pada artikel ini. Yaitu tentang Pengenalan Alat Dan Teknik Laboratorium Mikrobiologi, mari terlebih dahulu memahami teknik dasar dalam prinsip kerja Mikrobiologi. Mikrobiologi menuntut pengetahuan dan ketrampilan yang cukup dalam 5 teknik dasar yaitu inokulasi, inkubasi, isolasi, pengujian atau eksaminasi dan identifikasi. Masing-masing teknik dasar tersebur masih dapat dirinci lebih lanjut dan meliputi penggunaan alat dan teknik yang beragam.
Inokulasi adalah tindakan memasukkan sumber mikroba ke dalam suatu media. Sumber mikroba dapat berasal dari apa saja seperti tanah, udara, air, bahan makanan, air ludah. Adapun media adalah substrat dengan kandungan nutrien di dalamnya yang dibutuhkan bagi pertumbuhan mikroba. Untuk kepentingan inokulasi maka diperlukan beragam alat seperti jarum inokulasi, batang drügalsky, tabung reaksi dengan akuades steril untuk rangkaian pengenceran dan sebagainya. Sumber mikroba selanjutnya dapat ditumbuhkan pada beragam media sesuai dengan kebutuhannya, seperti Pembuatan Media Pertumbuhan Mikrobiologi Nutrien Agar.
Inkubasi adalah tindakan menumbuhkan mikroba pada kondisi lingkungan yang sesuai baik suhu, kelembaban, pH dan sebagainya. Untuk keperluan inkubasi, maka diperlukan sejumlah alat seperti inkubator.
Isolasi adalah suatu tindakan yang ditujukan untuk memisahkan suatu mikroba dari campurannya. Pertumbuhan mikroba langsung dari alam pada media akan memunculkan beragam koloni dari spesies yang bermacam-macam. Koloni pada dasarnya didefinisikan sebagai hasil proliferasi atau pertumbuhan mikroba dari satu sel menjadi banyak sel sehingga dapat dilihat sebagai noda atau bercak-bercak pada permukaan media padat. Koloni-koloni pada kondisi seperti ini belum tentu berarti berasal dari satu spesies yang murni sehingga perlu tindakan pemurnian yang dikenal sebagai isolasi. Untuk keperluan ini diperlukan kerja aseptis sehingga perlu media dalam cawan petri, bunsen burner, jarum ose dan sebagainya.
Eksaminasi adalah teknik dasar yang meliputi pengujian dan pengamatan terhadap kultur mikroba yang telah murni. Pada kegiatan eksaminasi umumnya meliputi kegiatan pengamatan mikromorfologi, makromorfologi, biokimiawi, mungkin pula serologi dan molekuler. Untuk keperluan tersebut menggunakan beragam alat seperti tabung reaksi, erlenmeyer, hemositometer, pH meter, mikroskop.
Identifikasi ditujukan untuk mengenali mikroba yang dieksaminasi terutama kelompok mikroba yang mana bahkan sampai ke spesies mikroba bersangkutan. Untuk kepentingan ini maka ragam informasi yang diperoleh dari eksaminasi sangat menentukan akurasinya. Ke Lima tahapan tersebut sangat penting, sebagai contohnya kita akan Melakukan Uji Aktivitas Enzimatis Mikroorganisme, jika di mulai dari awal maka kita harus melakukan yang namanya isolasi, inokulasi, inkubasi, identifikasi, Eksaminasi.
Pengenalan Alat Yang Umum Dalam Laboratorium Mikrobiologi
1. Mikroskop Cahaya (Brightfield Microscope)
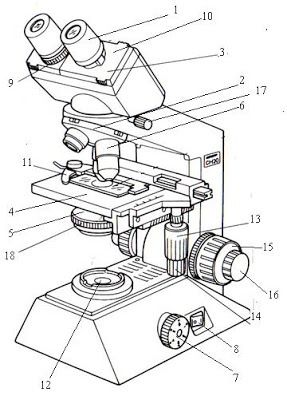
Salah satu alat untuk melihat sel mikroorganisme adalah mikroskop cahaya. Dengan mikroskop kita dapat mengamati sel bakteri yang tidak dapat dilihat dengan mata telanjang. Pada umumnya mata tidak mampu membedakan benda dengan diameter lebih kecil dari 0,1 mm. berikut merupakan uraian tentang cara penggunaan bagian-bagian dan spesifikasi mikroskop cahaya merk Olympus CH20 yang dimiliki Laboratorium Mikrobiologi. Untuk Lebih Jelas bisa membaca Artikel Penjelasan Mikroskop Lengkap.
Keterangan bagian-bagian Mikroskop:
- Eyepiece / oculars (lensa okuler) untuk memperbesar bayangan yang dibentuk lensa objektif.
- Revolving nosepiece (pemutar lensa objektif) untuk memutar objektif sehingga mengubah perbesaran.
- Observation tube (tabung pengamatan / tabung okuler).
- Stage (meja benda).
- Condenser (condenser) untuk mengumpulkan cahaya supaya tertuju ke lensa objektif
- Objective lense (lensa objektif).
- Brightness adjustment knob (knop pengatur kekuatan lampu) untuk memperbesar dan memperkecil cahaya lampu.
- Main switch (tombol on-off).
- Diopter adjustmet ring (cincin pengatur diopter) untuk menyamakan fokus antara mata kanan dan kiri.
- Interpupillar distance adjustment knob (pengatur jarak interpupillar).
- Specimen holder (penjepit spesimen).
- Illuminator (sumber cahaya).
- Vertical feed knob (knop pengatur vertikal) untuk menaikkan atau menurunkan object glass.
- Horizontal feed knob (knop pengatur horizontal) untuk menggeser ke kanan / kiri objek glas.
- Coarse focus knob (knop fokus kasar) untuk mengatur naik-turunnya meja benda (untuk mencari fokus) secara kasar dan cepat.
- Fine focus knob (knop fokus halus) untuk mengatur naik-turunnya meja benda secara halus dan lambat.
- Observation tube securing knob (knop pengencang tabung okuler).
- Condenser adjustment knob (knop pengatur kondenser) untuk menaik-turunkan kondenser
Prosedur Pengoperasian Mikroskop:
- Menyalakan lampu
- Tekan tombol on (8).
- Atur kekuatan lampu dengan memutar bagian (7)
- Menempatkan spesimen pada meja benda
- Letakan objek glas diatas meja benda (4) kemudian jepit dengan (11). Jika meja benda belum turun, diturunkan dengan knop kasar (15)
- Cari bagian dari objek glas yang terdapat preparat ulas (dicari dan diperkirakan memiliki gambar yang jelas) dengan memutar knop vertikal dan horizontal (13) dan (14)
- Memfokuskan
- Putar Revolving nosepiece (2) pada perbesaran objektif 4x lalu putar knop kasar (15) sehingga meja benda bergerak ke atas untuk mencari fokus.
- Setelah fokus perbesaran 4 x 10 didapatkan, maka putar (2) pada perbesaran selanjutnya yaitu perbesaran objektif 10x. kemudian putar knop halus (16) untuk mendapatkan fokusnya.
- Lakukan hal yang sama jika menggunakan perbesaran yang lebih tinggi
- Tambahan
- Jika perlu interpupillar distance adjustment knob (10) dapat digeser, hal ini akan mengubah dua bayangan yang akan diterima oleh 2 mata menjadi gambar yang tunggal sehingga sangat membantu dalam mengatasi kelelahan mata.
- Jika perlu diopter adjustment knob (9) dapat diatur untuk memperoleh bayangan focus yang seimbang antara mata kanan dan kiri.
- Pengaturan condenser (5) akan memperjelas bayangan yang tampak dengan mensetting pada posisi tertinggi (cahaya penuh).
Penentuan perbesaran total:
Ukuran specimen yang diamati dapat diperoleh dengan mengalikan perbesaran lensa okuler dengan lensa objektif. Misal = Okuler (10x) x Objektif (40x) = 400x
Penggunaan minyak imersi:
Semakin kecil nilai daya pisah, akan semakin kuat kemampuan lensa untuk memisahkan dua titik yang berdekatan pada preparat sehingga struktur benda terlihat lebih jelas. Daya pisah dapat diperkuat dengan memperbesarkan indeks bias atau menggunakan cahaya yang memiliki panjang gelombang (λ) pendek. Biasanya dapat digunakan minyak imersi untuk meningkatkan indeks bias pada perbesaran 10 x 100.
- Jika fokus pada perbesaran 10 x 40 telah didapatkan maka putar ke perbesaran objektif 100x.
- Geser sedikit object glass lalu tetesi minyak imersi 1 – 2 tetes minyak imersi.
- Geser kembali ke tempat asal, kemudian cari bayangan yang paling jelas dengan memutar knop halus.
- Cara lain meneteskan minyak imersi yaitu pada saat pemutaran dari perbesaran 40x ke perbesaran 100x. Jadi saat lensa objektif 100x belum pas duduknya atau belum tegak lurus dengan spesimen, minyak imersi diteteskan kemudian objektif 100x dilanjutkan pemutarannya sampai kedudukan yang pas. Selanjutnya dicari fokusnya.
- Jika telah selesai menggunakan mikroskop, bersihkan lensa objektif 100x dengan kertas lensa yang dibasahi xylol
2. Mikroskop Stereo (Zoom Stereo Microscope)
Mikroskop ini berfungsi untuk melihat objek yang membutuhkan perbesaran tidak terlalu besar. Di Laboratorium Mikrobiologi, mikroskop stereo biasanya digunakan untuk mengamati secara detail bentuk koloni dan jamur. Berikut merupakan uraian tentang mikroskop stereo yang dimiliki Laboratorium Mikrobiologi yaitu Zoom Stereo Microscope, Olimpus SZ3060.
Bagian-bagian mikroskop stereo:
- Oculars eyepiece (lensa okuler)
- Diopter adjustment ring (cincin pengatur diopter)
- Zoom control knob (knop pengatur pembesaran)
- Focusing knob (knop pengatur fokus)
- Stage plate (pelat tempat spesimen diletakkan)
- Stage clip (penjepit spesimen / preparat)
Prosedur pengoperasian mikroskop stereo:
- Letakkan spesimen / preparat di stage plate (5), jepit jika perlu.
- Atur perbesaran pada perbesaran terkecil dengan memutar Zoom Control Knob (3) kemudian dicari fokusnya dengan memutar Focusing Knob (4)
- Jika ingin mendapatkan bayangan yang lebih besar, putar Zoom Control Knob (3) ke perbesaran yang lebih tinggi kemudian dicari fokusnya.
3. Autoklaf (Autoclave)
Autoclave adalah alat untuk mensterilkan berbagai macam alat dan bahan menggunakan uap air panas bertekanan. Tekanan yang digunakan pada umumnya 15 Psi atau sekitar 2 atm dan dengan suhu 121oC (250oF). Jadi tekanan yang bekerja ke seluruh permukaan benda adalah 15 Psi (15 pounds per square inch). Lama sterilisasi yang dilakukan biasanya 15 menit untuk 121oC, tapi jika digunakan suhu 115oC, lama waktu autoclaving disarankan menjadi 20 menit.
Baca Juga : Alat Dan Prinsip Sterilisasi
Keterangan gambar autoklaf vertikal dan bagian-bagiannya:
- Tombol pengatur waktu mundur (timer)
- Katup pengeluaran uap
- pengukur tekanan
- katup pengaman
- Tombol on-off
- Termometer
- Lempeng sumber panas
- Air
- Clamp (plat pengaman)
- Angsang (plat berpori) yang merupakan maksimum air pemanas
Cara Penggunaan :
- Sebelum melakukan sterilisasi cek dahulu air dalam autoklaf. Jika air kurang dari batas yang ditentukan, maka dapat ditambah air sampai batas tersebut. Gunakan air hasil destilasi, untuk menghindari terbentuknya kerak dan karat.
- Masukkan peralatan dan bahan. Jika mensterilisasi botol bertutup ulir, maka tutup harus dikendorkan.
- Tutup autoklaf dengan rapat lalu kencangkan baut pengaman agar tidak ada uap yang keluar dari bibir autoklaf. Klep pengaman jangan dikencangkan terlebih dahulu.
- Nyalakan autoklaf, diatur timer dengan waktu minimal 15 menit pada suhu 121oC.
- Tunggu sampai air mendidih sehingga uapnya memenuhi kompartemen autoklaf dan terdesak keluar dari klep pengaman. Kemudian klep pengaman ditutup (dikencangkan) dan tunggu sampai selesai. Penghitungan waktu 15’ dimulai sejak tekanan mencapai 2 atm.
- Jika alarm tanda selesai berbunyi, maka tunggu tekanan dalam kompartemen turun hingga sama dengan tekanan udara di lingkungan (jarum pada preisure gauge menunjuk ke angka nol). Kemudian klep-klep pengaman dibuka dan keluarkan isi autoklaf dengan hati-hati.
4. Inkubator (Incubator)
Inkubator adalah alat untuk menginkubasi atau memeram mikroba pada suhu yang terkontrol. Alat ini dilengkapi dengan pengatur suhu dan pengatur waktu. Kisaran suhu untuk inkubator produksi Heraeus B5042 misalnya adalah 10-70oC.
5. Hot plate stirrer dan magnetic bar
Hot plate stirrer dan Stirrer bar (magnetic stirrer) merupakan alat pengaduk otomatis yang digerakkan oleh medan magnit, pengaduk yang digunakan adalah magnetic bar yang bergerak karena ada gerakan medan magnit. Alat ini disertai dengan pemanas yang dapat diatur suhunya (atau dengan pengatur suhu tunggal). Alat ini digunakan untuk menghomogenkan suatu larutan.
6. Colony counter
Alat ini berguna untuk mempermudah perhitungan koloni yang tumbuh setelah diinkubasi di dalam cawan karena adanya kaca pembesar. Selain itu alat tersebut dilengkapi dengan skala/ kuadran yang sangat berguna untuk pengamatan pertumbuhan koloni yang banyak. Jumlah koloni pada cawan petri dapat ditandai dan dihitung menggunakan alat hitung otomatis. Setelah selesai, angka yang tercatat pada alat hitung dapat di set ulang.
7. Biological Safety Cabinet
Biological Safety Cabinet (BSC) atau Laminar Air Flow (LAF) adalah alat yang berguna untuk bekerja secara aseptis karena BSC mempunyai pola pengaturan dan penyaring aliran udara sehingga menjadi udara yang lewat ruang BSC steril. Selain itu dengan kecepatan alir yang tinggi, udara yang steril akan mendorong udara yang tidak steril sehingga tidak dapat masuk ke ruang BSC. Alat BSC dilengkapi UV yang berfungsi sebagai disinfektan permukaan alat dan ruang BSC, sehingga biasanya UV di pasang atau on sekurangnya 2 jam sebelum aliran udara steril dialirkan. Karena sifatnya yang merusak, saat bekerja di BSC, lampu UV dimatikan. Prosedur penggunaan BSC seri 36212, Purifier™ Biological Safety Cabinet dari LABCONCO yang dimiliki laboratorium mikrobiologi adalah sebagai berikut:
- Hidupkan lampu UV selama 2 jam, selanjutnya matikan segera sebelum mulai bekerja.
- Pastikan kaca penutup terkunci dan pada posisi terendah.
- Nyalakan lampu neon dan blower.
- Biarkan selama 5 menit.
- Cuci tangan dan lengan dengan sabun gemisidal / alkohol 70 %.
- Usap permukaan interior BSC dengan alkohol 70 % atau desinfektan yang cocok dan biarkan menguap.
- Masukkan alat dan bahan yang akan dikerjakan, jangan terlalu penuh (overload) karena memperbesar resiko kontaminan.
- Atur alat dan bahan yang telah dimasukan ke BSC sedemikian rupa sehingga efektif dalam bekerja dan tercipta areal yang benar-benar steril.
- Untuk mempertahankan aseptis, dapat digunakan lampu bunsen berbahan bakar gas, tidak boleh menggunkan lampu bunsen berbahan bakar metanol.
- Kerja secara aseptis dan jangan sampai pola aliran udara terganggu oleh aktivitas kerja.
- Setelah selesai bekerja, biarkan 2-3 menit supaya kontaminan tidak keluar dari BSC.
- Usap permukaan interior BSC dengan alkohol 70 % dan biarkan menguap lalu tangan dibasuh dengan desinfektan.
- Matikan lampu neon dan blower
8. Pipet (pippete) atau Mikropipet dan Tip
Pipet adalah alat untuk memindahkan cairan dengan volume yang terukur, pada umumnya volume cairan yang dipindah dalam praktikum mikrobiologi berkisar 0,1 ml-10ml, tetapi dapat pula dalam volume yang hanya beberapa µl. Banyak pilihan kapasitas volume pipet, sebagian pipet dapat diatur volumenya sesuai kebutuhan (adjustable volume pipette) adapula yang hanya memiliki 1 ukuran volume tetap (fixed volume pipette). Untuk penggunaannya, pipet memerlukan memerlukan tip yang biasanya sekali pakai (dispossable).
Cara Penggunaan :
- Sebelum digunakan Thumb Knob sebaiknya ditekan berkali-kali untuk memastikan lancarnya pipet.
- Masukkan Tip bersih ke dalam Nozzle / ujung pipet.
- Tekan Thumb Knob sampai hambatan pertama / first stop, jangan ditekan lebih ke dalam lagi.
- Masukkan tip ke dalam cairan sedalam 3-4 mm.
- Tahan pipet dalam posisi vertikal kemudian lepaskan tekanan dari Thumb Knob maka cairan akan masuk ke tip.
- Pindahkan ujung tip ke tempat penampung yang diinginkan.
- Tekan Thumb Knob sampai hambatan kedua / second stop atau tekan semaksimal mungkin maka semua cairan akan keluar dari ujung tip.
- Jika ingin melepas tip putar Thumb Knob searah jarum jam dan ditekan maka tip akan terdorong keluar dengan sendirinya, atau menggunakan alat tambahan yang berfungsi mendorong tip keluar.
9. Cawan Petri (Petri Dish)
Cawan petri terdiri dari 2 keping, yaitu cawan basal (bagian bawah) dan tutup. Cawan petri digunakan untuk wadah membiakkan (kultivasi) mikroorganisme. Medium dapat dituang ke cawan bagian bawah dan selanjutnya ditutup. Cawan petri tersedia dalam berbagai macam ukuran, cawan petri yang biasadigunakan dalam praktikum mikrobiologi berdiameter 15 cm.
10. Pipet Ukur (Measuring Pippete)
Pipet ukur merupakan alat untuk memindahkan larutan dengan volume yang diketahui. Tersedia berbagai macam ukuran kapasitas pipet ukur, diantaranya pipet berukuran 1 ml, 5 ml dan 10 ml. Cara penggunaanya adalah cairan disedot dengan pipet ukur dengan bantuan filler sampai dengan volume yang diingini. Volume yang dipindahkan dikeluarkan menikuti skala yang tersedia (dilihat bahwa skala harus tepat sejajar dengan mensikus cekung cairan) dengan cara menyamakan tekanan filler dengan udara sekitar.
11. Pipet tetes (Pasteur Pippete)
Fungsinya sama dengan pipet ukur, namun volume yang dipindahkan tidak diketahui. Salah satu penerapannya adalah dalam menambahkan HCl / NaOH saat mengatur pH media, penambahan reagen ada uji biokimia, dll.
12. Tabung reaksi (Reaction Tube / Test Tube)
Di dalam mikrobiologi, tabung reaksi digunakan untuk uji-uji biokimiawi dan menumbuhkan mikroba.Tabung reaksi dapat diisi media padat maupun cair. Tutup tabung reaksi dapat berupa kapas, tutup metal, tutup plastik atau aluminium foil. Pada umumnya dengan volume tabung 15 ml.
13. Labu Erlenmeyer (Erlenmeyer Flask)
Berfungsi untuk menampung larutan, bahan atau cairan dan media pertumbuhan mikroba. Terdapat beberapa pilihan berdasarkan volume yaitu 25 ml, 50 ml, 100 ml, 250 ml, 300 ml, 500 ml, 1000 ml dan 2000 ml.
14. Gelas ukur (Graduated Cylinder)
Berguna untuk mengukur volume suatu cairan, seperti labu erlenmeyer, gelas ukur memiliki beberapa pilihan berdasarkan skala volumenya. Pada saat mengukur volume larutan, sebaiknya volume tersebut ditentukan berdasarkan meniskus cekung larutan.
15. Batang L (L Rod)
Batang L atau dikenal pula sebagai tangkai atau batang drügalsky bermanfaat untuk menyebarkan cairan di permukaan agar supaya bakteri yang tersuspensi dalam cairan tersebut tersebar merata. Karena perannya untuk menyebarkan secara merata maka disebut spreader.
16. Mortar dan Pestle
Mortar dan penumbuk (pastle) digunakan untuk menumbuk atau menghancurkan materi cuplikan, misal daging, roti atau tanah sebelum diproses lebih lanjut. Umumnya dari bahan gelas atau keramik
17. Beaker Glass
Beaker glass merupakan alat yang memiliki banyak fungsi. Di dalam mikrobiologi, dapat digunakan untuk preparasi media media, menampung akuades dan sebagainya. Memiliki kisaran volume bervariasi.
18. Pembakar Bunsen (Bunsen Burner)
Salah satu alat yang berperan dalam menciptakan lingkungan kerja aseptis atau untuk keperluan sterilisasi alat logam dan gelas tertentu. Pembakar bunsen atau lampu bunsen dapat menggunakan bahan bakar gas atau spiritus. Penggunaan dalam laminar hood harus berupa pembakar bunsen berbahan bakar gas.
19. Glass Beads
Glass beads adalah manik-manik gelas kecil, umumnya dengan diameter 3 mm-5 mm yang digunakan untuk meratakan suspensi biakan di atas permukaan agar dengan cara menggoyang. Glass beads digunakan pada teknik spread plate yang fungsinya sama dengan batang L atau batang drügalsky.
20. Tabung Durham
Tabung durham berbentuk mirip dengan tabung reaksi namun ukurannya lebih kecil dan berfungsi untuk menampung/menjebak gas yang terbentuk akibat metabolisme pada bakteri yang diujikan. Penempatannya terbalik dalam tabung reaksi dan harus terendam sempurna dalam media (jangan sampai ada sisa udara).
21. Jarum Inokulum
Jarum inokulum berfungsi untuk memindahkan biakan untuk ditanam/ditumbuhkan ke media baru. Jarum inokulum biasanya terbuat dari kawat nichrome atau platinum sehingga dapat berpijar jika terkena panas atau bahan lain seperti dispossable plastic yang digunakan sekali pakai tanpa dipijarkan. Bentuk ujung jarum dapat berbentuk lingkaran (loop) dan disebut ose atau inoculating loop/transfer loop, dan yang berbentuk lurus disebut inoculating needle/transfer needle. Inoculating loop cocok untuk melakukan streak di permukaan agar, sedangkan inoculating needle cocok digunakan untuk inokulasi secara tusukan pada agar tegak (stab inoculating). Jarum inokulum ini akan sangat bermanfaat saat membelah agar untuk preprasi Henrich’s Slide Culture.
22. Pinset
Pinset memiliki banyak fungsi diantaranya adalah untuk mengambil benda dengan menjepit misalnya saat memindahkan cakram antibiotik.
23. pH Indikator Universal
Indikator pH berguna untuk mengukur/mengetahui pH suatu larutan. Hal ini sangat penting dalam pembuatan media karena pH pada media berpengaruh terhadap petumbuhan mikroba. Kertas pH indikator dicelupkan sampai tidak ada perubahan warna kemudian strip warna dicocokkan dengan skala warna acuan.
24. Pipet Filler / Bulb
Filler adalah alat untuk menyedot larutan yang dapat dipasang pada pangkal pipet ukur. Karet sebagai bahan filler merupakan karet yang resisten bahan kimia. Filler memiliki 3 saluran yang masing-masing saluran memiliki katup. Katup yang bersimbol A (aspirate) berguna untuk mengeluarkan udara dari gelembung. S (suction) merupakan katup yang jika ditekan maka cairan dari ujung pipet akan tersedot ke atas. Kemudian katup E (exhaust) berfungsi untuk mengeluarkan cairan dari pipet ukur.
Baca Juga : Teknik Isolasi Mikroba